
As proteínas apresentam funções e estruturas diversificadas e são sintetizadas a partir de apenas 20 aminoácidos diferentes. São formadas por conjuntos de 100 ou mais aminoácidos, que podem repetir entre si. Formam os hormônios, anticorpos, as enzimas (catalisam reações químicas) e os componentes estruturais das células. Encontram-se no tecido muscular, nos ossos, no sangue e outros fluidos orgânicos.
Proteína (>100 AA): AA – AA – AA – AA – AA – AA – AA – AA – AA....- AA
Polipeptídeos (50 a 100 AA): AA – AA – AA – AA – AA – AA....- AA
Tripeptídeo (3 AA): AA – AA – AA
Dipeptídeos (2 AA): AA – AA
Aminoácido: AA


Estrutura química:
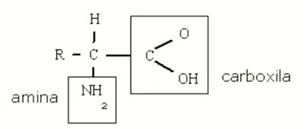
As proteínas são compostas de carbono, hidrogênio, nitrogênio, oxigênio e quase todas apresentam enxofre. Algumas apresentam elementos adicionais, como fósforo, ferro, zinco e cobre. Seu peso molecular é extremante elevado, devido ao número elevado de aminoácidos. Já os aminoácidos, apresentam na sua molécula, um grupo amino (-NH2) e um grupo carboxila (-COOH). A única exceção é o aminoácido prolina que contem um grupo imino (-NH-) no lugar do grupo amino.
Classificação das proteínas:
1) Proteína de alto valor biológico (AVB): Possuem em sua composição aminoácidos essenciais em proporções adequadas. É uma proteína completa. Ex.: proteínas da carne, peixe, aves e ovo.
2) Proteínas de baixo valor biológico (BVB): Não possuem em sua composição aminoácidos essenciais em proporções adequadas. É uma proteína incompleta. Ex.: cereais integrais e leguminosas (feijão, lentilha, ervilha, grão-de-bico, etc.).
3) Proteínas de referência: Possuem todos os aminoácidos essenciais em maior quantidade. Ex.: ovo, leite humano e leite de vaca.

Classificação dos aminoácidos:
Aminoácidos são unidades estruturais das proteínas. Eles se unem em longas cadeias, em várias estruturas geométricas e combinações químicas para formar as proteínas específicas.
 1) Aminoácidos essenciais: Precisam ser fornecidos através da dieta. São eles: Valina, lisina, treonina, leucina, isoleucina, triptofano, fenilalanina e metionina. A histidina e a arginina são essenciais para crianças até 1 ano de vida.
1) Aminoácidos essenciais: Precisam ser fornecidos através da dieta. São eles: Valina, lisina, treonina, leucina, isoleucina, triptofano, fenilalanina e metionina. A histidina e a arginina são essenciais para crianças até 1 ano de vida.
2) Aminoácidos não essenciais: Podem ser sintetizados pelo organismo em quantidades adequadas para uma função normal.
Valor biológico:
Determina a quantidade de proteínas encontradas nos alimentos que realmente são absorvidas pelo corpo. As proteínas que contém mais aminoácidos essenciais possuem melhor digestibilidade, tendo uma absorção no trato gastrointestinal mais eficiente. Para obter esta informação deve-se multiplicar o valor protéico de cada substância alimentar que compõem o cardápio, pelos fatores de utilização protéica, que são:
 Fator de correção
Fator de correção
Proteína de cereal = 0,5
Proteína de leguminosa = 0,6
Proteína animal = 0,7
Exemplo: 100g de arroz tem 7g de proteína
7g de proteína x 0,5 = 3,5g de proteína são absorvidas.
Funções das proteínas:
1) Reparam proteínas corpóreas gastas (anabolismo), resultantes do contínuo desgaste natural (catabolismo) que ocorre no organismo;
2) Constroem novos tecidos;
3) Fonte de calor e energia (fornecem 4 Kcal por grama); 4) Contribuem para diversos fluídos e secreções corpóreas essenciais, como leite, esperma e muco;
4) Contribuem para diversos fluídos e secreções corpóreas essenciais, como leite, esperma e muco;
5) Transportam substâncias;
6) Defendem o organismo contra corpos estranhos (anticorpos contra antígenos);
7) Exercem funções específicas sobre órgãos ou estruturas do organismo (hormônios);
8) Catalisam reações químicas (enzimas).
Aminoácido limitante:
Para se avaliar a qualidade de uma proteína, compara-se sua composição de aminoácidos, com a proteína padrão (do ovo), verifica-se qual dos aminoácidos da proteína em estudo está mais deficiente em relação à padrão. O aminoácido que se apresentar em menor quantidade, é o limitante.
Desnaturação protéica:
Caracteriza-se pela quebra das cadeias lipoprotéicas com a conseqüente desorganização da estrutura interna da proteína. Ocorre quando uma proteína é modificada em sua conformação, de tal modo que perde suas funções biológicas.
Balanço nitrogenado:
 É a diferença de nitrogênio (das proteínas) que é ingerido e a quantidade que é excretado.
É a diferença de nitrogênio (das proteínas) que é ingerido e a quantidade que é excretado.
1) Balanço nitrogenado equilibrado: Quando a quantidade de nitrogênio ingerido é igual a excretado. Ex.: adultos normais que não estão perdendo e nem aumentando a sua massa magra (músculos).
2) Balanço nitrogenado negativo: Quando a quantidade de nitrogênio ingerido é menor que a excretado. Ex.: estado de jejum, dieta pobre em proteínas, dieta restritiva, doenças altamente catabólicas como câncer e AIDS, etc.
3) Balanço nitrogenado positivo: Quando a quantidade de nitrogênio ingerido é maior que o excretado. Ex.: crianças (fase de crescimento), gestantes, treino de musculação com o objetivo de hipertrofia muscular, etc.
Digestão, absorção e metabolismo:
A digestão das proteínas começa no estômago, que devido a presença de ácido clorídrico, desnatura as proteínas (destrói as ligações de hidrogênio da estrutura química). Com isso, as cadeias proteolíticas perdem a forma e ficam mais acessíveis ao ataque das enzimas. A enzima pepsina transforma as proteínas em moléculas menores, hidrolisando as ligações peptídicas. No intestino delgado as proteínas sofrem a ação das enzimas produzidas pelo pâncreas (tripsina, quimotripsina, elastase e carboxipolipeptidase). Após, os peptídeos e aminoácidos absorvidos são transportados ao fígado através da veia porta. Apenas, 1% da proteína ingerida é excretada nas fezes. Os aminoácidos participarão na construção e manutenção dos tecidos, formação de enzimas, hormônios, anticorpos, no fornecimento de energia e na regulação de processos metabólicos (anabolismo e catabolismo).
 Necessidades diárias:
Necessidades diárias:
As necessidades diárias situam-se em torno de 0,8 a 1 grama por quilo de peso. Em relação à contribuição total das proteínas na ingestão calórica, recomenda-se cerca de 10 a 15%.

Fontes alimentares:
Origem animal: carnes (mamíferos, aves, pescados, etc.), vísceras, ovos, leite e derivados.
Origem vegetal: leguminosas secas (feijões, ervilha, lentilha, grão-de-bico, etc.) e cereais integrais (milho, trigo, etc.).